اوربیتال الکترونی چیست؟
اوربیتال های الکترونی نواحی سه بعدی اطراف هسته اتم هستند که الکترون خاصی در آن قرار دارد. هر اوربیتال می تواند دو الکترون را در خود نگه دارد. آنها همچنین به عنوان اوربیتال اتمی شناخته می شوند. اوربیتالهای اتمی بسته به تعداد الکترونهایی که اتم دارد، اشکال مختلفی دارند. با مدارهای s، اوربیتال p، اوربیتال d و اوربیتال f آشنا خواهیم شد. شکل مداری آنها را نیز یاد خواهیم گرفت.
دقیق تعریف از یک اوربیتال، یک تابع ریاضی است که مکان یک الکترون را در یک اتم بر اساس احتمال توصیف می کند. “اوربیتال اتمی” به طور کلی به منطقه ای از فضا اشاره می کند که ممکن است یک الکترون بر اساس تابع ریاضی آن اوربیتال وجود داشته باشد.
اوربیتال های منحط اوربیتال هایی در یک سطح انرژی اصلی و زیرسطح هستند که جهت گیری های متفاوتی دارند. برای مثال، 5 جهت اوربیتال های d در صفحه سه بعدی، اوربیتال های منحط هستند.

بررسی اولیه اعداد کوانتومی
برای جزئیات بیشتر در مورد اعداد کوانتومی، مقاله اعداد کوانتومی ما را بررسی کنید! چهار عدد کوانتومی وجود دارد که سطح انرژی، شکل، جهت گیری و اسپین الکترون اوربیتال ها را نشان می دهد.
- عدد کوانتومی اصلی (n): سطح انرژی اصلی یک الکترون را نشان می دهد. هرچه عدد کوانتومی اصلی بیشتر باشد، سطح انرژی بالاتر است و بنابراین فاصله بین هسته و الکترون خاص بیشتر است.
- عدد کوانتومی تکانه زاویه ای (ل): شکل یک اوربیتال را نشان می دهد. مقادیر مختلف از ل مربوط به اشکال خاص اوربیتال های الکترونی است. بعداً در این مورد با جزئیات بیشتر بحث خواهد شد.
- عدد کوانتومی مغناطیسی (متر): جهت گیری یک مدار به دور هسته را نشان می دهد. از آنجایی که اوربیتالهای مختلف شکلهای متفاوتی دارند، میتوان آنها را حول یک صفحه مختصات سه بعدی در جهتهای بسیاری چرخاند.
- عدد کوانتومی اسپین: جهتی را که یک الکترون در یک اوربیتال در حال چرخش است را نشان می دهد. فقط دو مقدار ممکن برای عدد کوانتومی اسپین وجود دارد: -1/2 و +1/2. حداکثر دو الکترون در هر اوربیتال وجود دارد، و اگر هر دو در اوربیتال باشند، باید در جهت مخالف در حال چرخش باشند (به این معنی که عدد کوانتومی اسپینی مخالف دارند).
تکانه زاویه ای عدد کوانتومی و اشکال مداری
عدد کوانتومی تکانه زاویه ای دارای مقادیر صحیح از 0 تا (n-1). بنابراین، اگر عدد کوانتومی اصلی (n) = 4، اعداد کوانتومی تکانه زاویه ای 0، 1، 2 و 3 هستند.
هر عدد کوانتومی تکانه زاویه ای یک حرف را نشان می دهد که مربوط به شکل خاصی از یک اوربیتال است. همانطور که می بینید، هرچه عدد کوانتومی اصلی بیشتر باشد، عدد کوانتومی تکانه زاویه ای بیشتر می شود و شکل مداری پیچیده تر می شود. بیشتر، شما فقط باید اوربیتال های s، اوربیتال p، اوربیتال d و f را بدانید – پس از اوربیتال f، اشکال بسیار پیچیده می شوند.
| کوانتومی اصلی # (n) | کوانتومی تکانه زاویه ای # (ل) | حرف | نمودار شکل مداری |
| 1 | 0 | س | 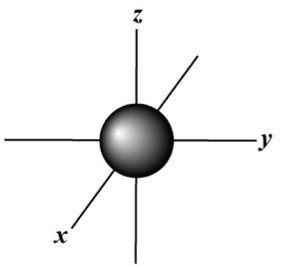 |
| 2 | 1 | پ |  |
| 3 | 2 | د |  |
| 4 | 3 | f |  |
چگونه الکترون ها فضای مداری را اشغال می کنند؟
S اوربیتال
در اولین سطح انرژی اصلی، زمانی که n=1 باشد، تنها سطح فرعی یا مداری ممکن اوربیتال s است که شکل کروی دارد.
P اوربیتال
هنگامی که n = 2، دو سطح فرعی امکان پذیر است: اوربیتال s و اوربیتال p. اگر به خاطر داشته باشید، عدد کوانتومی مغناطیسی جهت گیری یک اوربیتال را با مقادیر – نشان می دهد.ل به +ل. بنابراین یک اوربیتال s فقط یک عدد کوانتومی مغناطیسی دارد که 1 است، یعنی فقط یک جهت ممکن دارد. این منطقی است زیرا یک کره بدون توجه به اینکه چگونه بچرخد شکل یکسانی دارد. بنابراین، یک اوربیتال p دارای سه جهت ممکن است (اعداد کوانتومی مغناطیسی 1-، 0، 1).

نئون، آخرین عنصر در سطح انرژی دوم اصلی، 10 الکترون دارد. این الکترون ها چگونه توزیع و قرار می گیرند؟ 2 الکترون اول در اوربیتال 1s یا اوربیتال s در اولین سطح انرژی اصلی می روند. سپس، 2 الکترون بعدی در اوربیتال 2s یا اوربیتال s در دومین سطح انرژی اصلی اشغال می شوند. به یاد داشته باشید، چون فقط یک جهت اوربیتال s وجود دارد، در هر سطح انرژی فقط یک اوربیتال s وجود دارد. در نهایت، 6 الکترون آخر به طور مساوی به اوربیتال های 2p تقسیم می شوند. از آنجایی که یک اوربیتال p سه جهت دارد، در هر سطح انرژی سه اوربیتال p وجود دارد.

همانطور که در مثال بالا نشان داده شد، الکترون ها را می توان با اوربیتال هایی که در آن ساکن هستند شناسایی کرد. پیکربندی های الکترونی نشان می دهد که چگونه الکترون ها در اوربیتال های یک اتم سازماندهی می شوند.
بیشتر بدانید
برخی از مقالات مرتبط دیگر ما را بررسی کنید!
