مفاهیم اصلی
در این آموزش در سلول های گالوانیکی، موسوم به سلول های ولتایی، شما با اصول اولیه واکنش های ردوکس و نحوه اعمال این اطلاعات در سلول های الکتروشیمیایی آشنا خواهید شد. همچنین یاد خواهید گرفت که چگونه نیمه واکنش هایی را در کدام الکترود تعیین کنید و همچنین از این پتانسیل های نیمه واکنش استاندارد برای محاسبه پتانسیل سلول استفاده کنید.
دو نوع سلول الکتروشیمیایی وجود دارد – یک سلول ولتایی که سلول گالوانیکی نیز نامیده می شود و یک سلول الکترولیتی. سلولهای ولتایی الکتریسیته تولید میکنند، در حالی که سلولهای الکترولیتی از یک منبع انرژی برای هدایت یک واکنش به جلو استفاده میکنند.
در مقالات دیگر پوشش داده شده است
پتانسیل های کاهش استاندارد
سلول های الکترولیتی
متعادل کردن واکنش های ردوکس
محاسبه اعداد اکسیداسیون
مبانی واکنش های اکسیداسیون- احیا
در یک فرآیند الکتروشیمیایی، الکترونها از یک ماده به ماده دیگر جریان مییابند که به آن واکنش اکسایش-کاهش (اکسیداسیون- کاهش) میگویند. واکنش های ردوکس زمانی اتفاق می افتد که ماده ای به نام عامل اکسید کننده با گرفتن الکترون و احیا شدن ماده دیگری را اکسید می کند. در یک واکنش ردوکس، یک یادداشت ساده برای به خاطر سپردن جهت انتقال الکترونها «Oil Rig» است که مخفف «اکسیداسیون از دست میرود، کاهش در حال افزایش است». این به این واقعیت اشاره دارد که در اکسیداسیون، یک گونه الکترون از دست می دهد در حالی که در کاهش، گونه الکترون به دست می آورد.
در واکنشهایی که واکنشهای ردوکس نیستند، مانند واکنشهای اسید-باز، حالتهای اکسیداسیون عناصر تغییر نمیکند.
یک مثال ساده از واکنش اکسیداسیون، واکنش اکسید آهن (II) با مونوکسید کربن به شرح زیر است:
![]()
در این واکنش، آهن از حالت اکسیداسیون 3+ به 0 کاهش می یابد، در حالی که کربن از حالت اکسیداسیون 2+ به 4+ اکسید می شود. تمام واکنش های ردوکس یک گونه در حال اکسید شدن و یک گونه کاهش می یابد.
برخی از عناصر، مانند وانادیوم، حتی می توانند از طریق چندین حالت اکسیداسیون با پیشرفت واکنش ردوکس پیشرفت کنند.
سلول های الکتروشیمیایی
دو نوع سلول الکتروشیمیایی وجود دارد: گالوانیکی و الکترولیتی.
را سلول گالوانیکی سابقه طولانی دارد این نام از فیزیکدان ایتالیایی لوئیجی گالوانی (1737 – 1798) گرفته شده است، که مشاهده کرد که عضلات پاهای قورباغه جدا شده با اعمال جریان الکتریکی به آنها منقبض می شوند. یک سلول گالوانیکی از انرژی آزاد شده از یک واکنش ردوکس خود به خود برای تولید جریان الکتریکی استفاده می کند. نام رایج دیگر سلول های گالوانیکی است سلول های ولتاییکه به نام فیزیکدان ایتالیایی دیگر، الساندرو ولتا (1745 – 1827) که سلول گالوانیکی (ولتائیک) را اختراع کرد، نامگذاری شده است.
از سوی دیگر، یک سلول الکترولیتی از یک جریان الکتریکی برای هدایت یک واکنش ردوکس غیر خود به خودی استفاده می کند. یک مثال معمولی از یک سلول الکترولیتی اعمال جریان الکتریکی به آب برای هدایت تجزیه آب به گازهای هیدروژن و اکسیژن از طریق واکنش زیر است:
![]()
شباهت های اصلی بین سلول های گالوانیکی و الکترولیتی این است که هر دو از دو الکترود آند و کاتد استفاده می کنند و حاوی محلول الکترولیت هستند. این محلول الکترولیت امکان انتقال یونها به داخل و خارج از محلول را فراهم میکند و در عین حال بار کلی سلول را خنثی نگه میدارد.
تفاوت عمده بین سلول گالوانیکی و الکترولیتی در جهت کار است. یک سلول گالوانیکی یک واکنش شیمیایی خود به خود را به کار قابل استفاده تبدیل می کند، در حالی که یک سلول الکترولیتی از کار برای ایجاد یک واکنش غیر خود به خودی استفاده می کند.
![]()
اکسیداسیون در آند اتفاق می افتد در حالی که کاهش در کاتد اتفاق می افتد. یادگاری آسان برای به خاطر سپردن این “گربه قرمز و گاو” است، که در آن “گربه قرمز” به معنای کاهش – کاتد، و “گاو” به معنای آند – اکسیداسیون است.
تعیین پتانسیل سلول های گالوانیکی
سلول گالوانیکی Cu-Zn (سلول ولتایی) را در تصویر زیر در نظر بگیرید

همانطور که در تصویر مشاهده می کنید، دو الکترود وجود دارد. یکی از آنها روی و دیگری مس است. برای تعیین اینکه کدام الکترود آند و کدام کاتد است، باید دو نیمه واکنش را در نظر گرفت. نیمه واکنش واکنش خالصی است که با اکسید شدن یا کاهش گونه ها اتفاق می افتد و جریان الکترون ها را نشان می دهد. دو نیمه واکنش را در سلول Cu-Zn در نظر بگیرید:

هنگامی که دو نیمه واکنش مانند این داده می شود، گونه هایی با پتانسیل کاهش بالاتر معمولا کاهش می یابد. به همین دلیل، میتوانیم ببینیم که در سلول Cu-Zn، مس کاهش مییابد در حالی که روی اکسید میشود. در مرحله بعد، باید نیمه واکنش روی را برگردانیم تا واکنش اکسیداسیون را نشان دهیم:
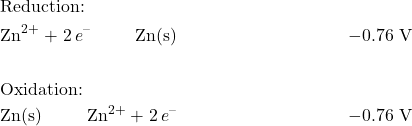
توجه داشته باشید که اگرچه ما معادله شیمیایی را تغییر دادیم، پتانسیل کاهش استاندارد منفی باقی می ماند.
از نیمهواکنش کاهش مس و نیمهواکنش اکسیداسیون روی، میتوانیم واکنش خالص ردوکس خالص را با جمع کردن آنها با هم و اطمینان از جمع شدن صحیح الکترونها ایجاد کنیم:
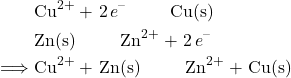
سپس می توانیم از معادله استفاده کنیم ![]() برای تعیین پتانسیل کلی سلول. برای سلول Cu-Zn ما، پتانسیل به صورت زیر محاسبه می شود:
برای تعیین پتانسیل کلی سلول. برای سلول Cu-Zn ما، پتانسیل به صورت زیر محاسبه می شود:
![]()
به یاد بیاورید که کاهش در کاتد و اکسیداسیون در آند رخ می دهد. می توانید در مورد محاسبه پتانسیل سلول بیشتر بخوانید اینجا.
نمودارهای سلولی
درک نمودار سلولی بسیار ساده است. مفهوم نمودار سلولی ارائه یک نماد خطی راحتتر است که به راحتی مرزهای فاز را با یک خط عمودی منفرد و پل نمک را با یک خط عمودی دوتایی نشان میدهد.
![]()
پیروی از این قرارداد برای سلول Cu-Zn ما را به نمودار سلولی زیر هدایت می کند:
![]()
سلول ولتایی و سلول گالوانیکی – ادامه مطلب را بخوانید
در اینجا با آند روی در سلول های الکتروشیمیایی آشنا شوید!
سلول گالوانیکی خود را از یک بسازید باتری سیب زمینی
برای محاسبات در شرایط غیر استاندارد، از معادله نرنست استفاده کنید!
