مفاهیم اصلی قانون دالتون
در سال 1801 شیمیدان انگلیسی جان دالتون مشاهداتی در مورد بخار و هوا انجام داد که در سال 1802 منتشر شد و در نهایت به دلیل قانون فشار جزئی دالتون. در این آموزش، شما یاد خواهید گرفت که فشار جزئی چیست، چگونه فشار جزئی یک گاز را پیدا کنید، و چگونه قانون دالتون آن را به کسر مولی مرتبط می کند.
موضوعات تحت پوشش در مقالات دیگر
گازهای متعدد
یک مخزن حاوی 1 مول گاز نئون را در نظر بگیرید. بگذارید فشار 1-اتمسفر باشد. حال، در نظر بگیرید که اگر یک مول دیگر گاز نئون اضافه کنید چه اتفاقی میافتد.
از مقاله ما در مورد فشار، فشار چیست، می دانیم که فشار ناشی از برخورد ذرات گاز با دیواره ظرف است. از آنجایی که دوبرابر کردن مقدار مول گاز، مقدار ذرات گاز را دو برابر می کند، می دانیم که اضافه کردن این مول دوم گاز، فشار را دو برابر می کند.
حال، در نظر بگیرید چه اتفاقی میافتد اگر به جای اضافه کردن یک مول دیگر گاز نئون، یک مول هلیوم اضافه کنیم. مقدار ذرات موجود در یک مول بدون توجه به ماده یکسان است، بنابراین می دانیم که مقدار ذراتی که اضافه می کنیم مانند قبل است.
بنابراین، می توان نتیجه گرفت که با افزودن بیشتر گاز متفاوت، فشار مخزن افزایش می یابد.
فشار جزئی
در مخزن از قبل حاوی نئون و هلیوم، فشار 2 اتمسفر خواهد بود، زیرا مقدار کل مول ها 2 مول است و هر مول یک اتمسفر را اعمال می کند.
از این نتیجه می توان دریافت که مقدار فشار وارد شده توسط هر گونه گاز است نه 2 اتمسفر کامل، اما در عوض بخشی از کل فشار است.
قانون فشار جزئی دالتون
قانون فشار جزئی دالتون بیان میکند که مجموع این بخشها به کل فشار ظرف اضافه میشود – یعنی مجموع فشارهای نئون و هلیوم از مخزن قبل از جمع شدن به کل فشار مخزن میشود.
از اینجا می توانیم معادله را مشاهده کنیم: ![]() . این معادله قانون دالتون است و می توان از آن برای تعیین فشار کل یک سیستم استفاده کرد.
. این معادله قانون دالتون است و می توان از آن برای تعیین فشار کل یک سیستم استفاده کرد.
کسرهای مول و فشار جزئی
قبلاً به مقدار مساوی گاز اضافه می کردیم. اگر به جای آن قسمت های نابرابر اضافه کنیم چه اتفاقی می افتد؟
همان مخزن قبلی را در نظر بگیرید، به جز اینکه به جای 1 مول گاز نئون، ابتدا 3 مول اضافه می کنیم. از قانون آووگادرو می دانیم که فشار متناسب با مقدار مول خواهد بود، بنابراین در این حالت فشار گاز نئون 3 مول خواهد بود.
سپس 1 مول گاز هلیوم اضافه می کنیم. در حال حاضر، مقدار کل مول گاز دو برابر نشده است، بلکه 33 درصد افزایش یافته است. به همین دلیل، تنها 33 درصد بیشتر برخورد با دیواره کانتینر وجود دارد و بنابراین فشار تنها 1 اتمسفر افزایش می یابد.
از این رو می بینیم که فشار کلی 4 اتمسفر و کل مول ها 4 مول می شود. ما می توانیم کسر مولی گاز هلیوم را بگیریم، ![]() و ببینید که برابر با 0.25 است. این نیز کسری از فشاری است که توسط گاز هلیوم وارد می شود.
و ببینید که برابر با 0.25 است. این نیز کسری از فشاری است که توسط گاز هلیوم وارد می شود.
به همین دلیل، فشار جزئی یک گاز را می توان با کسر مولی آن از طریق معادله تعیین کرد ![]() ، جایی که
، جایی که ![]() کسر مولی گاز 1 است.
کسر مولی گاز 1 است.
مسئله مثال قانون دالتون
چگونه فشار جزئی را پیدا کنیم
در اینجا مثالی از نحوه حل مسئله در مورد قانون فشار جزئی دالتون و چگونگی یافتن فشار جزئی گاز آورده شده است.
یک مخزن با 32 گرم گاز اکسیژن و 12 گرم گاز هلیوم پر می شود. فشار کل در مخزن 4 اتمسفر است. فشار جزئی اکسیژن و گاز هلیوم چقدر است؟
ابتدا مقدار مول های گاز اکسیژن و هلیوم را تعیین کنید.

سپس، کسر مولی هر دو گاز اکسیژن و هلیوم را تعیین کنید.
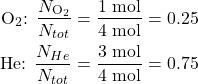
در نهایت، از کسر مول برای تعیین فشار جزئی استفاده کنید.

