مفاهیم اصلی:
در این آموزش نحوه خواندن جدول تناوبی را خواهید آموخت. ما نگاهی دقیق به گروه های جدول تناوبی خواهیم داشت. علاوه بر این، با ویژگی های مختلف گروه ها، دوره ها و خانواده های جدول تناوبی آشنا خواهید شد. اگر از این مقاله لذت می برید، حتماً مقالات دیگر ما را بررسی کنید!
مقالات مرتبط:
واژگان
- عناصر: ماده خالصی است که از یک اتم تشکیل شده است.
- گروه ها: ستون عمودی جدول تناوبی که تعداد الکترون های ظرفیت یک عنصر را نشان می دهد.
- دوره ها: ردیف های افقی در جدول تناوبی که تعداد لایه های الکترونی یک عنصر را نشان می دهد.
- خانواده ها: عناصری که تعداد الکترون های ظرفیت یکسان و در نتیجه خواص مشابه دارند.
جدول تناوبی و روندهای دوره ای

جدول تناوبی به گروه ها (ستون های عمودی)، دوره ها (ردیف های افقی) و خانواده ها (گروه هایی از عناصر مشابه) سازماندهی شده است. عناصر در همان گروه تعداد الکترون های ظرفیت یکسانی دارند. در همین حال، عناصر در همان عادت زنانه تعداد لایه های الکترونی اشغال شده یکسانی دارند. در سال 1869 شیمیدان روسی دیمیتری مندلیف متوجه شد که یک الگوی ذاتی سازماندهی برای عناصر شیمیایی وجود دارد. از این کسر جدول تناوبی را تشکیل داد. توجه به این نکته مهم است که مکان عناصر در این جدول چگونه ویژگی های آنها را به ما می گوید. یک راه سریع برای درک خواص شیمیایی و فیزیکی یک عنصر، دانستن روندهای دوره ای است. این روندها به شما می گویند که بیشترین و کمترین نوع خواص در جدول تناوبی در کجا متمرکز شده اند. برای توضیح عمیق تر روندهای دوره ای، اینجا را کلیک کنید.
گروه در مقابل دوره
گروه ها ستون های جدول تناوبی و نقطه ها ردیف ها هستند. 18 گروه وجود دارد و 7 دوره به اضافه لانتانیدها و اکتینیدها وجود دارد.
دوره های جدول تناوبی
بنابراین یک دوره در جدول تناوبی چیست؟ دوره ها ردیف های افقی جدول تناوبی هستند. در مجموع هفت دوره وجود دارد و هر عنصر در یک دوره دارای تعداد اوربیتال های اتمی یکسانی است. دوره بالا که حاوی هیدروژن و هلیوم است، تنها دو اوربیتال دارد. با پایین آمدن ردیف ها، تعداد اوربیتال ها افزایش می یابد. در زیر جدولی برای کمک به نمایش عدد تناوبی و اوربیتال های مربوطه وجود دارد.
| شماره دوره | تعداد اوربیتال ها | تعداد عناصر |
| 1 | 1 | 2 |
| 2 | 2 | 8 |
| 3 | 3 | 8 |
| 4 | 4 | 18 |
| 5 | 5 | 18 |
| 6 | 6 | 32 |
| 7 | 7 | 32 |
گروه های جدول تناوبی
همانطور که قبلا ذکر شد، ستون های عمودی جدول تناوبی را “گروه” می نامند. در مجموع هجده گروه در جدول تناوبی وجود دارد و هر کدام گروه جدول تناوبی حاوی عناصری با همان تعداد است الکترون های ظرفیت
تعداد الکترون های ظرفیت موجود، ویژگی های یک عنصر را دیکته می کند. دلیل این امر این است که الکترون های ظرفیت، که الکترون های بیرونی ترین پوسته هستند، آنهایی هستند که در واکنش های شیمیایی شرکت می کنند. این الکترون ها یا اهدا می کنند، می پذیرند یا به اشتراک می گذارند. علاوه بر این، هرچه پوسته ظرفیت پرتر باشد، عنصر پایدارتر است.
در جدول تناوبی چند گروه وجود دارد؟
در جدول تناوبی 18 گروه وجود دارد که در هر ستون جدول تناوبی یک گروه وجود دارد. اولین ستون سمت چپ گروه 1 و آخرین ستون سمت راست گروه 18 است.
گروه ها و الکترون های ظرفیت
گروه اول کمترین پایداری را دارند زیرا فقط یک الکترون ظرفیت دارد. در همین حال، گروه هجده پایدارترین است زیرا این عناصر دارای پوسته ظرفیت کامل (هشت الکترون ظرفیت) هستند. در زیر جدولی وجود دارد که اعداد گروه را به تعداد الکترون های ظرفیت مرتبط می کند.
| شماره گروه | تعداد الکترون های ظرفیت |
| 1 | 1 |
| 2 | 2 |
| 3-12 | 2 |
| 13 | 3 |
| 14 | 4 |
| 15 | 5 |
| 16 | 6 |
| 17 | 7 |
| 18 | 8 |
خانواده های جدول تناوبی
در جدول تناوبی، وجود دارد خانواده ها که گروهی از عناصر با خواص مشابه هستند. این خانواده ها عبارتند از فلزات قلیایی، فلزات قلیایی خاکی، فلزات واسطه، فلزات پس از گذار، متالوئیدها، هالوژن ها، فلزات نجیب و گازهای نجیب. بسیاری از این خانواده ها متعلق به یک گروه واحد در جدول تناوبی هستند. با این حال، همه خانواده ها با گروه های جدول تناوبی همپوشانی ندارند. به عنوان مثال، فلزات واسطه شامل همه عناصر از گروه سه تا گروه دوازده هستند. در زیر یک جدول تناوبی وجود دارد که مکان هر خانواده را نشان می دهد.
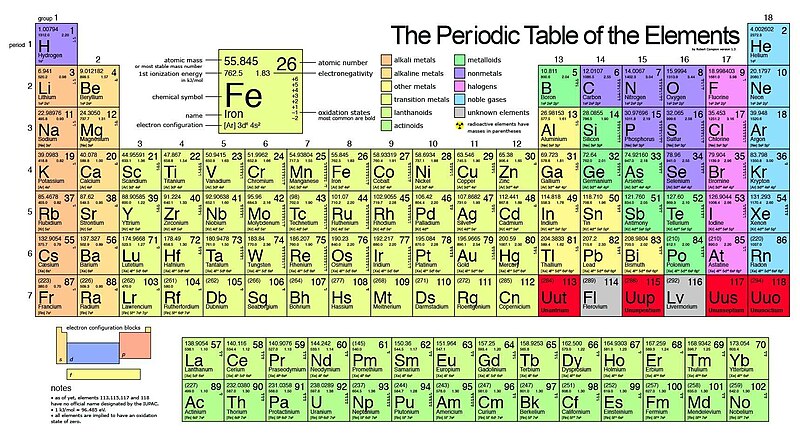
فلزات قلیایی (گروه 1)
فلزات قلیایی از تمام عناصر گروه یک به استثنای هیدروژن تشکیل شده است. این عناصر به شدت واکنش پذیر هستند و به همین دلیل معمولاً در ترکیبات یافت می شوند. علاوه بر این، آنها به آب حساس هستند (آنها به شدت با آب واکنش نشان می دهند)، بنابراین باید در روغن ذخیره شوند. واکنش پذیرترین فلز قلیایی فرانسیم است و با بالا رفتن از گروه کاهش می یابد. این بدان معناست که لیتیوم کمترین واکنش را دارد. از نظر فیزیکی، خانواده فلزات قلیایی نقره ای، سفید و سبک هستند. آنها همچنین دارای نقطه ذوب پایین و نقطه جوش پایین هستند.
فلزات قلیایی زمین (گروه 2)
فلزات قلیایی خاکی دومین خانواده واکنش پذیر در جدول تناوبی (پس از فلزات قلیایی) هستند. علاوه بر این، آنها عوامل کاهنده قوی هستند، به این معنی که در واکنش های شیمیایی الکترون اهدا می کنند. آنها همچنین رسانای حرارتی و الکتریکی خوبی هستند. از نظر فیزیکی چگالی کم، نقطه ذوب پایین و نقطه جوش کم دارند.
فلزات خاکی کمیاب: لانتانیدها
لانتانیدها خانواده ای از فلزات خاکی کمیاب هستند که حاوی یک الکترون ظرفیت در پوسته 5 بعدی هستند. آنها بسیار واکنش پذیر و یک عامل کاهنده قوی در واکنش ها هستند. علاوه بر این، آنها یک فلز نقره ای روشن هستند و نسبتا نرم هستند. آنها همچنین دارای نقطه ذوب بالا و نقطه جوش بالایی هستند. خاک های کمیاب شامل عناصری مانند نئودیمیم و اربیوم است.
فلزات خاکی کمیاب: اکتینیدها
اکتینیدها خانواده دیگری از فلزات خاکی کمیاب هستند. مانند لانتانیدها، این عناصر بسیار واکنش پذیر هستند. آنها همچنین دارای الکتروپوزیتیویته بالایی هستند و رادیواکتیو هستند. علاوه بر این، این عناصر دارای خواص پارامغناطیس، پیرومورفیک و آلوتروپیک هستند. از نظر فیزیکی، آنها بسیار شبیه به لانتانیدها هستند. آنها فلزات نقره ای هستند که نرم، چکش خوار و انعطاف پذیر هستند.
فلزات انتقالی (گروه های 3-11)
فلزات واسطه معمولاً دو یا چند حالت اکسیداسیون را تشکیل می دهند. انرژی یونیزاسیون پایین و رسانایی بالایی دارند. علاوه بر این، آنها دارای نقطه ذوب بالا، نقطه جوش بالا و رسانایی بالا هستند. از نظر فیزیکی هم فلزی و هم چکش خوار هستند.
پست انتقال فلز
فلزات پس از انتقال بین فلزات واسطه و متالوئیدها قرار دارند. در دمای استاندارد، آنها در حالت جامد از ماده هستند. آنها تمایل به چگالی بالا و همچنین رسانایی بالا دارند. از نظر فیزیکی، آنها چکش خوار و انعطاف پذیر هستند.
متالوئیدها
متالوئیدها خواص فلزات و غیر فلزات را نشان می دهند. برای مثال، فلزات رسانای خوبی هستند و غیر فلزات رسانای ضعیفی هستند. این بدان معناست که متالوئیدها نیمه هادی هستند (فقط در دماهای بالا الکتریسیته را هدایت می کنند). همچنین، شکنندهتر از فلزات هستند، اما شکنندهتر از غیر فلزات هستند. از نظر فیزیکی آنها می توانند براق یا کدر باشند و معمولاً انعطاف پذیر و چکش خوار هستند.
هالوژن ها (گروه 17)
نام هالوژن در یونانی به معنای “نمک ساز” است. این امر در طبیعت مشهود است زیرا هالوژن ها با فلزات برهمکنش می کنند و نمک های مختلفی را تشکیل می دهند. در نکته دیگر، هالوژن ها گروه منحصر به فردی از عناصر هستند. آنها تنها خانواده تناوبی هستند که حاوی عناصری در سه حالت ماده در دمای استاندارد هستند. 6 هالوژن وجود دارد و در گروه 17 قرار دارند. این عناصر شامل فلوئور (F)، کلر (Cl)، برم (Br)، ید (I) و استاتین (At) است. آنها غیر فلزات بسیار واکنش پذیر، بسیار الکترونگاتیو و بسیار سمی هستند.
فلزات نجیب
فلزات نجیب شامل روتنیم (Ru)، اسمیم (Os)، رودیوم (Rh)، ایریدیوم (Ir)، Pd، پلاتین (Pt)، طلا (Au)، نقره (Ag) هستند. مانند گازهای نجیب به دلیل داشتن پوسته ظرفیت کامل بی اثر هستند. علاوه بر این، فلزات نجیب دارای تمایلات کاتالیزوری هستند. همچنین در برابر خوردگی، کدر شدن و اکسیداسیون بسیار مقاوم هستند. در نهایت، مانند بسیاری از فلزات دیگر، آنها نرم و انعطاف پذیر هستند.
گازهای نجیب (گروه 18)
گازهای نجیب که آئروژن نیز نامیده می شوند، گازهای بی اثر هستند. برخی از نمونه ها عبارتند از آرگون، کریپتون و نئون. آنها را می توان در گروه هجده در جدول تناوبی یافت. به همین ترتیب، این بدان معنی است که آنها یک پوسته ظرفیت کامل دارند. به همین دلیل، آنها پایدار و نسبتاً غیر واکنشی هستند. علاوه بر این، گازهای نجیب دارای نقطه جوش کم و نقطه ذوب پایین هستند. از نظر فیزیکی بی رنگ هستند و بو ندارند.
جدول خلاصه برای خواص خانواده
| نوع خانواده | خواص |
| فلزات قلیایی | – بسیار واکنش پذیر – حساس به آب – نرم – چگالی کم – نقطه ذوب پایین – نقطه جوش کم |
| فلزات قلیایی زمین | – عوامل کاهنده قوی – فلز نقره ای و براق – هادی های خوب – چگالی کم – نقطه ذوب پایین – نقطه جوش پایین |
| فلزات واسطه | – 2 یا بیشتر حالت اکسیداسیون – معمولاً ترکیبات پارامغناطیس را تشکیل می دهد – انرژی های یونیزاسیون پایین – نقطه ذوب بالا – نقطه جوش بالا – رسانایی بالا – متالیک – شکل پذیر |
| فلزات پس از انتقال | – جامد در دمای استاندارد – شکل پذیر – هادی – رسانایی بالا – تراکم بالا |
| متالوئیدها | – نیمه هادی ها (فقط در دماهای بالا رسانا می شود) – ترد تر از فلزات اما شکننده تر از غیر فلزات – خواص ترکیبی است بین فلزات و غیر فلزات – براق یا کدر – شکل پذیر و چکش خوار |
| لانتانیدها | – 1 الکترون ظرفیت در پوسته 5 بعدی – بسیار واکنش پذیر – عامل کاهنده قوی – فلز روشن نقره ای – نسبتا نرم – نقطه ذوب بالا – نقطه جوش بالا |
| اکتینیدها | – بسیار واکنش پذیر – الکتروپوزیتیویته بالا – پارامغناطیس – پیرومورفیک – آلوتروپیک – رادیواکتیو – فلزات نقره ای – هادی – شکل پذیر – نرم |
| هالوژن ها | – بسیار واکنش پذیر – الکترونگاتیوی بالا – غیر فلز – سمی |
| فلزات نجیب | – نسبتاً غیر واکنشی – پوسته ظرفیت کامل (8 الکترون ظرفیت) – بی اثر – کاتالیزوری – مقاوم در برابر خوردگی، کدر شدن و اکسیداسیون – نرم و انعطاف پذیر |
| گازهای نجیب | – نسبتاً غیر فعال – پوسته ظرفیت کامل (8 الکترون ظرفیت) – الکترونگاتیوی پایین – بی رنگ و بی بو – گازها در شرایط استاندارد – غیر فلز – نقطه جوش پایین – نقطه ذوب پایین – با پایین آمدن چگالی افزایش می یابد |
بیشتر خواندن
ساختار یک اتم
روندهای دوره ای آسان شد!
