نظریه VSEPR چیست؟

نظریه VSEPR مخفف عبارت Valence Shell Electron Pair Repulsion Theory است، روشی برای سازماندهی مولکول ها بر اساس ساختار هندسی آنها. در شیمی، نظریه VSEPR بر این اصل استوار است که هر اتم در یک مولکول به دنبال هندسهای است که فاصله بین جفتهای الکترون ظرفیت را به حداکثر برساند، بنابراین دافعه الکترون-الکترون را به حداقل میرساند. الکترون های ظرفیت یکدیگر را دفع می کنند زیرا بار منفی دارند و بارهای مشابهی دفع می کنند.
VSEPR نظریه مولکولهای بدون جفت الکترون تنها در اتم مرکزی
برای سادگی و سازماندهی، ساختارهای VSEPR را به دو دسته تقسیم میکنیم: آنهایی که دارای جفتهای تنها در اتم مرکزی هستند و آنهایی که جفتهای تنها در اتم مرکزی ندارند.
خطی
BeF2 نمونه ای از یک مولکول خطی است. 16 الکترون ظرفیت کل در یک BeF وجود دارد2 مولکول، با سه جفت تنها (شش الکترون) روی هر اتم فلوئور. برای اینکه این جفت های تنها در هر اتم فلوئور مربوطه در دورترین فاصله ممکن از اتم فلوئور دیگر باشند، مولکول یک خط مستقیم را تشکیل می دهد. ما به این شکل به عنوان “خطی” اشاره می کنیم. زوایای پیوند در یک مولکول خطی 180 درجه است. CO2 و BeH2 همچنین مولکول های خطی هستند.

پلنار مثلثی
BF3 نمونه ای از یک مولکول مسطح مثلثی است. 24 الکترون ظرفیت کل در یک BF وجود دارد3 مولکول برای اینکه هر اتم فلوئور جفت های تک خود را تا حد امکان از سایر اتم های فلوئور دور نگه دارد، مولکول یک شکل مثلثی و دو بعدی را تشکیل می دهد. در هندسه مولکولی، این به عنوان “مسطح مثلثی” شناخته می شود. زوایای پیوند در یک مولکول مسطح مثلثی 120 درجه است. CO3 (کربنات) نمونه دیگری از یک مولکول مسطح مثلثی است.
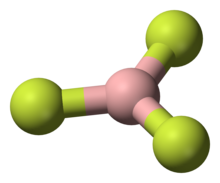
چهار وجهی
یک مثال رایج از یک مولکول چهار وجهی CH است4 (متان). در یک مولکول متان هشت الکترون ظرفیت کل وجود دارد. برای اینکه چهار هیدروژن از یکدیگر دورتر باشند، به شکل چهار وجهی می رسیم. چهار وجهی بیان سه بعدی هندسه مسطح مربع است. زاویه پیوند HCH در یک مولکول چهار وجهی 109.5 درجه است.

تریگونال دو هرمی
PF5 نمونه ای از یک مولکول دو هرمی تریگونال است. PF5 دارای 38 الکترون ظرفیت کل. هر پیوند PF از 2 الکترون ظرفیت استفاده می کند و هر اتم فلوئور دارای سه جفت تک است. فسفر می تواند هشت خود را گسترش دهد. سه اتم فلوئور در موقعیتی قرار دارند که به آن موقعیت استوایی می گویند. دو مورد دیگر در موقعیت محوری قرار دارند. برای اینکه فلوئورهای استوایی در بیشترین فاصله ممکن از یکدیگر قرار گیرند، پیوندهای PF نسبت به یکدیگر در زاویه 120 درجه قرار دارند و زوایای پیوند بین موقعیت استوایی و محوری 90 درجه است.

هشت وجهی
SF6 نمونه ای از یک مولکول هشت وجهی است. در یک SF 48 الکترون ظرفیتی وجود دارد6 مولکول هر پیوند SF حاوی دو الکترون ظرفیت است و هر اتم فلوئور سه جفت تنها را حمل می کند. گوگرد می تواند هشت خود را گسترش دهد. دافعه بین اتم های فلوئور را می توان با قرار دادن هر یک در گوشه یک هشت وجهی به حداقل رساند.

تئوری VSEPR مولکول هایی با جفت الکترون های تنها در اتم مرکزی
خم شد
اچ2O نمونه ای از یک مولکول خمیده است. هنگامی که اتم مرکزی در یک مولکول دارای جفت های تک باشد، این جفت های تنها پیوندهای ریشه دار در اتم مرکزی را دفع می کنند. در یک مولکول آب، جفت های تنها روی اتم اکسیژن پیوندهای هیدروژنی را در فضای دو بعدی به سمت پایین وادار می کنند. زاویه پیوند بین اتم های هیدروژن 104 درجه است.
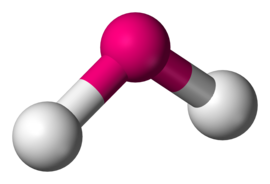
هرمی مثلثی
NH3 نمونه ای از یک مولکول هرمی مثلثی است. در مولکول آمونیاک، جفت تنها روی اتم نیتروژن مرکزی، به دلیل دافعه الکترون-الکترون، سه پیوند NH را به سمت پایین می راند.
الاکلنگ
SF4 نمونه ای از یک مولکول با شکل الاکلنگ است. در یک SF4 مولکول، دو تا از پیوندهای SF در مقابل یکدیگر در صفحه استوایی قرار دارند. دو پیوند SF دیگر در فضای سه بعدی از یکدیگر دور می شوند. این اجازه می دهد تا اتم های فلوئور بیشترین فاصله را از یکدیگر داشته باشند، با توجه به اینکه یک جفت الکترون تنها در اتم گوگرد مرکزی وجود دارد. این جفت تنها پیوندهای SF را از بین می برد، دقیقاً مانند هندسه های هرمی خمیده یا مثلثی.

تی شکل
BrF3 نمونه ای از یک مولکول T شکل است. در یک BrF3 مولکول، دو جفت تنها روی اتم مرکزی برم وجود دارد که باعث دافعه شدید الکترون-الکترون با پیوندهای Br-F نسبت به سایر هندسه ها می شود. این شکل زوایای پیوند 86.2 درجه را ایجاد می کند که منحصر به مولکول های T شکل است.

هرمی مربع
در یک BrF5 مولکول، هندسه نزدیک به هندسه هشت وجهی تقلید می کند. تنها تفاوت این است که در هندسه هرمی مربع، یکی از اتم های محوری با یک جفت الکترون تنها جایگزین می شود.
مربع مسطح
در مولکول مسطح مربع XeF4، هندسه تقریباً شبیه هرمی مربعی است، اما برای آن، پیوند محوری با یک جفت الکترون تنها جایگزین شده است. این هر چهار پیوند Xe-F را به یک آرایش مسطح و استوایی هل می دهد.

روش AX
روش AX روشی جایگزین برای بیان هندسه های مولکولی است. در مدل AX، A نشان دهنده اتم مرکزی است. X نشان دهنده اتم مرکزی، X نشان دهنده تعداد پیوندهای منفرد متصل به اتم مرکزی، و E نشان دهنده تعداد جفت الکترون های تنها واقع در اتم مرکزی است.
| تبر | خطی |
| تبر3 | پلنار مثلثی |
| تبر2E | خم شد |
| تبر6 | هشت وجهی |
| تبر5 | دو هرمی |
| تبر4 | چهار وجهی |
| تبر3E | هرمی |
| تبر3E2 | الاکلنگ |
| تبر3E2 | تی شکل |
| تبر5E | هرمی مربع |
| تبر4E2 | مربع مسطح |
نمودار VSEPR و شماره استریک
این نمودار VSEPR همه هندسههای رایج VSEPR را به شما نشان میدهد که بر اساس عدد فضایی و تعداد جفت الکترونهای تک آنها سازماندهی شدهاند. عدد فضایی تعداد اتم هایی است که به یک اتم مرکزی یک مولکول به اضافه تعداد جفت الکترون های تک متصل به آن اتم متصل شده اند. در تئوری دافعه جفت الکترون لایه ظرفیتی برای یافتن هندسه مولکولی استفاده می شود.

کاربرد دنیای واقعی نظریه VSEPR
خواص شیمیایی برخی از مولکولها اغلب ساختار هندسی آنها را منعکس میکند و VSEPR بهترین راه برای اظهار نظر علمی درباره ساختار یک مولکول خاص است.
خواصی که اغلب با ساختار مولکولی نشان داده می شوند عبارتند از قطبیت، رنگ، دیامغناطیس/پارامغناطیس و فعالیت بیولوژیکی. ساختارهای هندسی همچنین به شیمیدانان و دیگر دانشمندان راهی مفید برای سازماندهی مولکول ها می دهد.
جمع بندی نظریه VSEPR
تئوری دافعه جفت الکترون لایه ظرفیتی روشی برای پیشبینی هندسه مولکولها است. این بر اساس این مفهوم اصلی است که الکترون ها به دلیل بارهای مشابه خود یکدیگر را دفع می کنند و مولکول ها خود را به گونه ای می سازند که بیشترین فاصله ممکن را بین جفت الکترون های تنها قرار دهد. اکثر مولکولهای ابتدایی میتوانند در 11 دسته شکل مختلف قرار بگیرند، و ما میتوانیم آنها را به سادگی با دانستن تعداد الکترونهای ظرفیت، تشخیص اتم مرکزی و با استفاده از نظریه VSEPR به طور دقیق پیشبینی کنیم.
