مفاهیم اصلی
پیوند های هیدروژنی یک نیروی بین مولکولی ضروری هستند که مسئول بسیاری از اعمال مولکولی به طور خاص در سیستم های بیولوژیکی هستند. در این آموزش، با تعریف پیوندهای هیدروژنی، مثال ها و چرایی اهمیت آنها در شیمی و زیست شناسی آشنا می شویم.
موضوعات تحت پوشش در مقالات دیگر
واژگان
- نیروی بین مولکولی: نیروهای بین مولکول های در حال تعامل در یک ماده. اینها با نیروهای درون مولکولی که نیروهایی هستند که بین اتمهای درون یک مولکول وجود دارند، متفاوت هستند.
- پیوند یونی: پیوندی که به دلیل جاذبه الکترواستاتیکی بین دو یون با بار مخالف ایجاد می شود. مثال: نه+ و Cl– تشکیل یک پیوند یونی برای ایجاد NaCl
- پیوند کووالانسی: پیوندی که به دلیل اشتراک الکترون دو اتم ایجاد می شود. مثال: CO
- دوقطبی: بار جزئی بر روی یک اتم به دلیل حرکت طبیعی الکترون ها که منجر به بارهای مثبت و منفی جزئی بر روی یک مولکول خنثی می شود.
پیوندهای هیدروژنی چیست؟
پیوندهای هیدروژنی نوعی نیروی بین مولکولی هستند که بین هیدروژن در یک مولکول و اتم الکترونگاتیو مولکول دیگر ایجاد می شود. به طور خاص، آنها فقط بین ترکیباتی که حاوی هیدروژن و یک یا چند اتم زیر هستند رخ می دهند: اکسیژن، فلوئور یا نیتروژن. یک راه هوشمندانه برای به خاطر سپردن پیوندهای هیدروژنی فقط با این مولکول ها این است که “شیمی FON (سرگرم کننده) است.” پیوندهای هیدروژنی قوی ترین از سه نوع نیروی بین مولکولی هستند.
آیا پیوندهای هیدروژنی همان پیوندهای کووالانسی هستند؟
خیر. پیوندهای هیدروژنی یک بیننیروی مولکولی، در حالی که پیوندهای کووالانسی هستند داخلنیروی مولکولی این پیوندها اغلب در بسیاری از ترکیبات کووالانسی وجود دارند اما بسیار متفاوت از پیوندهای کووالانسی هستند. اگرچه این پیوندها قوی هستند، اما به اندازه پیوندهای کووالانسی قوی نیستند و اغلب به طور مداوم شکسته و اصلاح می شوند.
پیوندهای هیدروژنی چگونه ایجاد می شوند؟
این پیوندها زمانی اتفاق میافتند که هیدروژن یک دوقطبی مثبت در یک مولکول و فلوئور، اکسیژن یا نیتروژن یک دوقطبی منفی در مولکول دیگر تشکیل دهد. دوقطبی مثبت هیدروژن به دوقطبی منفی روی اتم الکترونگاتیو جذب می شود و باعث ایجاد جاذبه بین دو مولکول می شود.
نمونه هایی از پیوندهای هیدروژنی
درک پیوندهای هیدروژنی با نگاه کردن به نمونه های رایج پیوند هیدروژنی ساده تر می شود.
پیوند هیدروژنی در آب
پیوند هیدروژنی در آب به دلیل اهمیت آنها در بسیاری از خواص آب، اغلب رایج ترین نمونه از این پیوندها است. در آب، پیوند هیدروژنی بین اکسیژن یک مولکول و هیدروژن مولکول دیگر ایجاد می شود.
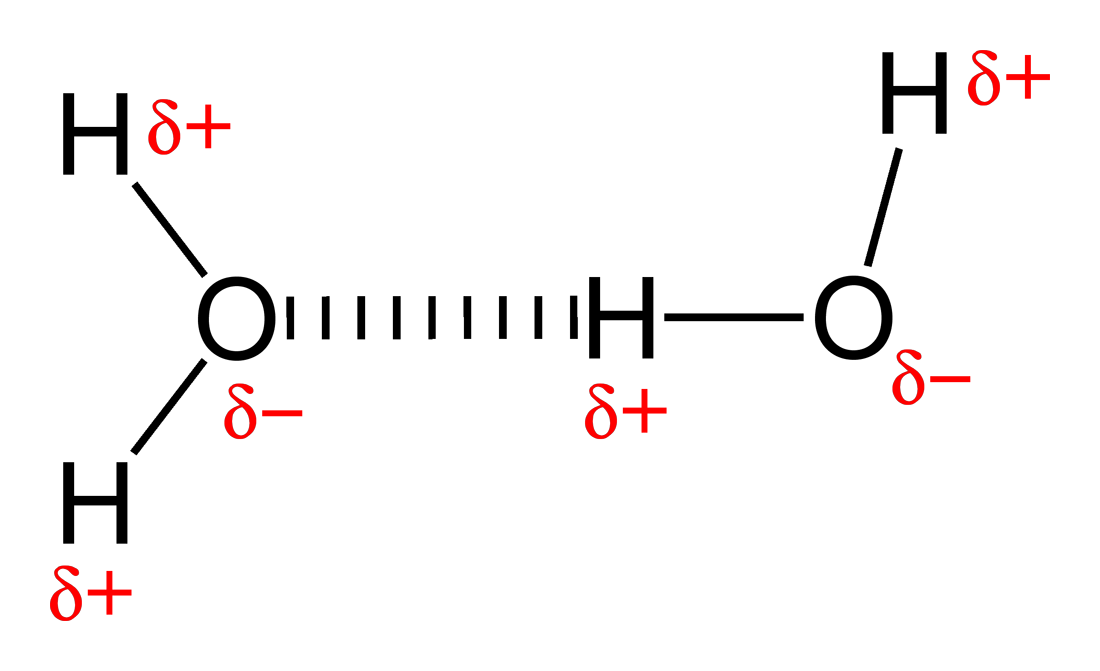
این پیوندها خواص مهمی در آب مانند چسبندگی (قابلیت چسبیدن آب به خود)، چسبندگی (قابلیت چسبیدن آب به مولکولهای دیگر)، کشش سطحی، گرمای ویژه بالا و خواص حلال آن را در آب ایجاد میکنند.
پیوند هیدروژنی در DNA
پیوندهای هیدروژنی در زیست شناسی بسیار مهم هستند، زیرا دلیل ساختار DNA و خواص آن هستند. این پیوندها مسئول اتصال بین دو رشته DNA بین جفت بازهای نوکلئوتیدی هستند. آدنین و تیمین بین آنها دو پیوند هیدروژنی و سیتوزین و گوانین سه پیوند تشکیل می دهند. این پیوندها DNA را در شکل گیری مارپیچ دوگانه آن نگه می دارند. علاوه بر این، این پیوندها برای تکثیر DNA مهم هستند، زیرا استحکام پیوندها رشته ها را در کنار هم نگه می دارد، اما آنقدر ضعیف هستند که با مقداری نیرو شکسته شوند و اجازه می دهند تا رشته ها در زمان تکثیر از هم جدا شوند.

این پیوندها همچنین دلیلی هستند که DNA و بسیاری از پروتئین ها دارای pH و دمای مطلوب هستند. اگر pH پایین باشد، به این معنی است که غلظت بالایی از H وجود دارد+ یون ها از آنجایی که این یونها واکنشپذیر هستند، میتوانند پیوندهای هیدروژنی را بشکنند و با پیوند به اتم الکترونگاتیو جایگزین آنها شوند. همین امر ممکن است زمانی رخ دهد که PH بالا باشد، یعنی غلظت بالایی از OH وجود دارد– یون ها اکسیژن منفی برای هیدروژن ها جذاب است، که می تواند منجر به شکستن پیوند و تشکیل پیوند جدیدی بین اکسیژن موجود در هیدروکسید و هیدروژن در جفت باز DNA شود. اطلاعات بیشتر در مورد pH را اینجا بخوانید.
این پیوندها می توانند توسط دما نیز شکسته شوند. با گرم شدن سیستم، مولکول ها شروع به حرکت سریع تر می کنند و انرژی کافی برای شکستن پیوند هیدروژنی به دست می آورند. از آنجایی که این پیوندها برای ساختار DNA و بسیاری از پروتئین ها ضروری هستند، می توانند منجر به تغییرات مضر در سیستم های بیولوژیکی شوند.
پیوند هیدروژنی در داروها
پیوندهای هیدروژنی هنگام در نظر گرفتن ترکیب a ضروری هستند دارو و نحوه تعامل آن در بدن به طور خاص، اگر دارویی بر روی یک مولکول هدف خاص اثر می گذارد، باید به نوعی به مولکول متصل شود تا عملکرد آن را تغییر دهد. برای اینکه این اتصال اتفاق بیفتد، پیوندهای هیدروژنی ضروری هستند زیرا به دارو اجازه می دهند تا محکم به یک محل فعال روی یک مولکول متصل شود. این را می توان در فعل و انفعالات آنزیم- سوبسترا نیز مشاهده کرد، جایی که پیوندهای هیدروژنی امکان اتصال محکم و در عین حال برگشت پذیر را فراهم می کند.
پیوند هیدروژنی و نقطه جوش
همانطور که قبلاً گفته شد، پیوندهای هیدروژنی قوی ترین نیروی بین مولکولی هستند. در نتیجه هنگامی که فشار یا دمای یک ماده افزایش می یابد، این پیوندها به چالش کشیده می شوند. از آنجایی که این پیوندها قوی هستند، برای شکستن این پیوندها انرژی بیشتری نسبت به شکستن نیروهای واندروال یا دوقطبی دوقطبی نیاز است.

به عنوان مثال، این جدول تغییر چشمگیر نقطه جوش را نشان می دهد که زمانی که پیوندهای هیدروژنی در یک ترکیب وجود دارد رخ می دهد. در این حالت، تنها با تغییر جزئی در ساختار مولکول، نقطه جوش سه برابر می شود و امکان ایجاد این پیوندها را فراهم می کند. همانطور که در بالا نشان داده شده است، آنها همچنان ضعیف تر از پیوندهای کووالانسی یا یونی هستند، اما واضح است که استحکام آنها باعث پایداری بیشتر می شود که منجر به تغییر چشمگیر در نقطه جوش می شود.
