در این مقاله به بررسی انواع پیوندها در شیمی می پردازیم. ما توضیح میدهیم که پیوند شیمیایی چیست، انواع پیوندهای شیمیایی را فهرست میکنیم و مثالهایی برای پیوند شیمیایی میآوریم. پیوندها در شیمی بسیار مهم هستند، زیرا بسیاری از خواص شیمیایی یک ترکیب را دیکته می کنند.
پیوند شیمیایی
هنگامی که اتم ها به یکدیگر جذب می شوند و به هم می پیوندند و یک مولکول تشکیل می دهند، اتصال بین هر اتم را یک می نامیم. پیوند شیمیایی. پیوند اتمهای موجود در مولکول، یون یا کریستال را با هم نگه میدارد. پیوندها اغلب می توانند برای مدت نامحدودی باقی بمانند، تا زمانی که توسط یک نیرو یا انرژی خارجی از هم جدا شوند.
پیوند شیمیایی جاذبه بین دو یا چند اتم است که به آنها اجازه می دهد تا بتوانند یک ترکیب شیمیایی پایدار را تشکیل دهند. ماهیت خاص یک پیوند شیمیایی می تواند متفاوت باشد، اما رایج ترین آنها پیوندهای کووالانسی و یونی هستند. با این پیوندها، انرژی کافی بین اتم ها زمانی که یک اتم کمتر است، فراهم می کند. این نیروی جاذبه است که اتم ها را نگه می دارد و به الکترون ها اجازه می دهد با هم پیوند ایجاد کنند.
اوراق قرضه اولیه و ثانویه
پیوند شیمیایی می تواند یکی از دو نوع باشد. اوراق قرضه اولیه و ثانویه در پیوند اولیه، پیوندهای کووالانسی، یونی و فلزی وجود دارد. در پیوندهای ثانویه، پیوندهای هیدروژن و واندروالس وجود دارد. این پیوندها نسبت به پیوندهای اولیه ضعیف تر و دورتر هستند، زیرا شامل یون یا اشتراک الکترون نیستند.
پیوند شیمیایی انواع
انواع پیوندها در شیمی چیست؟ بیایید به سه نوع از محبوب ترین پیوندها نگاه کنیم – پیوندهای کووالانسی، پیوندهای یونی، و پیوندهای فلزی.
پیوندهای کووالانسی
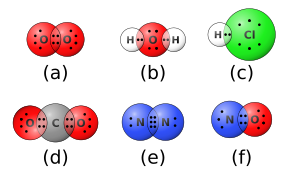
پیوند کووالانسی یا پیوند مولکولی، یک پیوند شیمیایی است که بین دو اتم تشکیل شده است که یک جفت الکترون مشترک دارند. عناصر تشکیل دهنده این پیوندها عموماً غیرفلزی هستند. چند نمونه از اکسیژن، هیدروژن و نیتروژن در ترکیباتی مانند O2 و اچ2O). مشخصه بارز پیوند کووالانسی این است که چگالی الکترون در وسط پیوند زیاد است. این بدان معناست که احتمال یافتن الکترون در بین دو اتم بیشتر از هر انتها است. شیمیدانان گاهی اوقات راه هایی را که پیوندهای کووالانسی تشکیل می دهند با استفاده از مدلی به نام توصیف و پیش بینی می کنند نظریه اوربیتال مولکولی.
اوراق قرضه چندگانه
پیوندهای کووالانسی می توانند یک یا چند پیوند باشند. در یک پیوند، تنها یک جفت الکترون ظرفیت بین دو اتم به اشتراک گذاشته می شود. با این حال، گاهی اوقات اتم ها بیش از یک جفت الکترون را به اشتراک می گذارند و چیزی را تشکیل می دهند که پیوند چندگانه نامیده می شود. انواع رایج پیوندهای چندگانه دو و سه گانه هستند که پیوندهای مرتبه بالاتر فقط در ترکیبات عجیب و غریب خاصی از فلزات واسطه تشکیل می شوند. عناصری که اغلب در پیوندهای چندگانه شرکت می کنند عبارتند از: کربن، نیتروژن، اکسیژن، فسفر و گوگرد.
قطبیت باند
یک پیوند شیمیایی کووالانسی می تواند قطبی یا غیر قطبی باشد. یک پیوند کووالانسی قطبی الکترون ها را به طور نامساوی تقسیم می کند، به این معنی که توزیع نامتعادل است و یک اتم با بار منفی جزئی و اتم دیگر با بار مثبت جزئی باقی می گذارد. یک پیوند کووالانسی غیرقطبی، الکترونها را به طور مساوی در بین هر دو اتم به اشتراک میگذارد، و در نتیجه توزیع متعادلی ایجاد میکند و تنها میتواند واقعاً بین دو اتم از یک عنصر تشکیل شود. با این حال، گاهی اوقات شیمیدانان با استفاده از تفاوت الکترونگاتیوی بین اتم ها، بین پیوندهای کووالانسی “بیشتر” غیرقطبی و پیوندهای کووالانسی قطبی تمایز قائل می شوند. اگر اختلاف الکترونگاتیوی کمتر از حدود 0.4 واحد باشد، یک پیوند معمولاً غیرقطبی در نظر گرفته می شود. اگر اختلاف بیش از 0.4 باشد، پیوند با این استاندارد قطبی است. با اختلاف بیش از 1.8 واحد، پیوند دیگر اصلا کووالانسی نیست، اما یونی (پایین را ببینید).
پیوندهای یونی
این نوع پیوند شیمیایی شامل انتقال الکترون از یک اتم به اتم دیگر، معمولاً از یک فلز به یک غیرفلز است (مثالهایی شامل NaCl و Li2O).

- یک ترکیب یونی دارای بارهای مثبت و منفی کامل است زیرا الکترون ها توسط اتم های الکترونگاتیو تر به اشتراک گذاشته نمی شوند، بلکه “دزدیده می شوند”.
- اتمی که الکترون از دست می دهد دارای بار مثبت است، در حالی که اتمی که الکترون می گیرد دارای بار منفی است.
پیوندهای فلزی
پیوندهای فلزی پیوندهای شیمیایی بین اتم های یک فلز هستند. این پیوندها مانند دریایی از الکترونهایی که آزادانه حرکت میکنند، همه اتمهای فلز را به یکباره به هم متصل میکنند (برخلاف پیوندهای کووالانسی، که در آن اتمها جفتهای گسسته الکترونها را روی بخشهای خاصی از یک مولکول به اشتراک میگذارند). این پیوندهای شیمیایی مسئول بسیاری از خواص فلزات حجیم از جمله درخشندگی و هدایت الکتریکی و حرارتی آنها هستند.
پیوند شیمیایی موضوعات در مقالات دیگر
پیوند شیمیایی و قانون اکتت
اتم ها دارای الکترون هایی به نام الکترون های ظرفیتی هستند که در دورترین فاصله از هسته قرار دارند و در پیوندهای شیمیایی شرکت می کنند. این الکترون ها باید به اشتراک گذاشته یا منتقل شوند تا به قانون اکتت دست یابیم که بیان می کند اتم ها باید هشت الکترون در پوسته بیرونی خود داشته باشند تا به ثبات دست یابند. با این حال، این قانون فقط برای عناصر گروه اصلی مانند کربن و نیتروژن اعمال می شود.
بور یک استثنای قابل توجه از قانون هشتگانه است، زیرا اغلب ترجیح می دهد تنها 6 الکترون داشته باشد و ترکیباتی مانند BF3 یا اسید بوریک (H3BO3) را تشکیل دهد. عناصر در ردیف سوم جدول تناوبی و فراتر از آن می توانند یک اکتت منبسط شده داشته باشند، به این معنی که آنها بیش از هشت الکترون در لایه ظرفیت خود دارند. فسفر، گوگرد و ید عناصر رایجی هستند که می توانند دارای هشت منبسط شده باشند.
